ЎЎЎЎУЙғЙ·N»тғЙ·NТФЙПФӘЛШҪMіЙөДјғғфОп·Qһй»ҜәПОпЎЈЛб����ЎўүA���Ўўы}ЎўСх»ҜОпКЗЧоіЈТҠөД»ҜәПОп���ЎЈЛбФЪЛ®ЦРДЬ®a(chЁЈn)ЙъHЈ«�Ј¬ДЬЕcүAЎўүAРФСх»ҜОп����Ўў»оқҠҪрҢЩЎўДіР©ы}·ҙ‘Ә(yЁ©ng)��Ј»үAФЪЛ®ЦРДЬ®a(chЁЈn)ЙъOHЈӯ����Ј¬ДЬЕcЛб�ЎўЛбРФСх»ҜОпЎўДіР©ы}·ҙ‘Ә(yЁ©ng)���Ј»ы}ФЪЛ®ЦРДЬ®a(chЁЈn)ЙъҪрҢЩк–лxЧУ(»тд@ёщлxЧУ)әНЛбёщлxЧУ�����Ј¬Лб�����ЎўүA�����Ўўы}ФЪ№ӨЮr(nЁ®ng)ҳI(yЁЁ)Йъ®a(chЁЈn)әНИХіЈЙъ»оЦРөДҸV·ә‘Ә(yЁ©ng)УГ��Ј¬ҙЩЯM(jЁ¬n)БЛИЛоҗОДГчөДЯM(jЁ¬n)ІҪәНЙз•юөДҝЙіЦАm(xЁҙ)°l(fЁЎ)Х№�ЎЈ
ЎЎЎЎөШЗтЙПә¬МјөД»ҜәПОп·ЗіЈ¶аЈ¬ФЪТС°l(fЁЎ)¬F(xiЁӨn)өДОпЩ|(zhЁ¬)ЦРә¬МјөД»ҜәПОпХјҪ^ҙуІҝ·Ц�����Ј¬ИЛӮғ°СПсЖПМСМЗЯ@оҗә¬МјөД»ҜәПОпҪРЧцУРҷC(jЁ©)»ҜәПОп�Ј¬әҶ·QУРҷC(jЁ©)ОпЈ»ҪMіЙЦРІ»ә¬МјөД»ҜәПОпТ»°гҪРЧцҹoҷC(jЁ©)»ҜәПОп���Ј¬ИзЛ®�ЎўСх»Ҝг~���ЎўҡдСх»Ҝвc����ЎўБтЛб�����ЎўВИЛбвӣЎўВИ»Ҝвc�����ЎўПхЛбд@өИ¶јҢЩУЪҹoҷC(jЁ©)»ҜәПОп����ЎЈОТӮғКмПӨөДТ»Сх»ҜМјЎў¶юСх»ҜМј�ЎўМјЛбв}өИЙЩ”ө(shЁҙ)ә¬Мј»ҜәПОпЈ¬УЙУЪЛьӮғөДҪMіЙәНРФЩ|(zhЁ¬)ЕcҹoҷC(jЁ©)»ҜәПОпәЬПаЛЖ����Ј¬ИЛӮғҫНҢўЛьӮғҡwИлҹoҷC(jЁ©)»ҜәПОпҒнСРҫҝ����ЎЈ
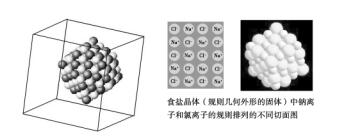
ЎЎЎЎОТӮғЦӘөА»оқҠҪрҢЩ(ИзKЎўCa�����ЎўNa����ЎўMgөИ)ФӯЧУҪY(jiЁҰ)ҳӢ(gЁ°u)ЧоНвҢУлҠЧУ”ө(shЁҙ)Э^ЙЩ��Ј¬УРК§ИҘлҠЧУЯ_(dЁў)өҪ8лҠЧУПаҢҰ·Җ(wЁ§n)¶ЁҳӢ(gЁ°u)РНөДғAПт��Ј»¶ш»оқҠ·ЗҪрҢЩ(ИзF����ЎўO���ЎўClөИ)ФӯЧУҪY(jiЁҰ)ҳӢ(gЁ°u)ЧоНвҢУлҠЧУ”ө(shЁҙ)Э^¶а�Ј¬УРөГөҪлҠЧУЯ_(dЁў)өҪ8лҠЧУПаҢҰ·Җ(wЁ§n)¶ЁҳӢ(gЁ°u)РНөДғAПт�ЎЈТтҙЛЈ¬®”(dЁЎng)»оқҠҪрҢЩЕc»оқҠ·ЗҪрҢЩ»ҜәП•r�����Ј¬»оқҠҪрҢЩФӯЧУК§ИҘЧоНвҢУЙПөДлҠЧУРОіЙк–лxЧУ���Ј¬»оқҠ·ЗҪрҢЩФӯЧУҪY(jiЁҰ)әПлҠЧУРОіЙкҺлxЧУ�Ј¬кҺ�Ўўк–лxЧУйgНЁЯ^ОпАнмoлҠЧчУГРОіЙБЛ·Җ(wЁ§n)¶Ё»ҜәПОпЈ¬ОТӮғ°СЯ@·NУЙкҺк–лxЧУҳӢ(gЁ°u)іЙөД»ҜәПОп·QһйлxЧУ»ҜәПОп�����ЎЈ
ЎЎЎЎіэ»оқҠҪрҢЩЕc»оқҠ·ЗҪрҢЩ•юРОіЙлxЧУ»ҜәПОпНвЈ¬Һ§ХэлҠәЙөДФӯЧУҲF(tuЁўn)(Изд@ёщ)ЕcҺ§Ш“(fЁҙ)лҠәЙөДЛбёщлxЧУ(ИзClЈӯ����ЎўNO3ЈӯЎўSO42Јӯ�ЎўCO32Јӯ)ТІ•юРОіЙлxЧУ»ҜәПОпЎЈҙуІҝ·ЦүAәНы}�Ўў»оқҠҪрҢЩСх»ҜОпөИ¶јКЗлxЧУ»ҜәПОпЈ¬ФЪ№Муw о‘B(tЁӨi)ПВ���Ј¬кҺ���Ўўк–лxЧУйgТтһйУРЭ^ҸҠ(qiЁўng)өДмoлҠЧчУГЈ¬Я@Р©лxЧУҫщІ»ДЬЧФУЙТЖ„У�ЎЈ
ЎЎЎЎФЪДҝЗ°ТСЦӘ»ҜәПОпЦР�Ј¬ФS¶а»ҜәПОпІўІ»ҙжФЪҪрҢЩФӘЛШЈ¬¶шКЗИ«ІҝУЙ·ЗҪрҢЩФӘЛШҪMіЙөД�ЎЈ®”(dЁЎng)·ЗҪрҢЩФӘЛШЕc·ЗҪрҢЩФӘЛШПа»ҜәП•rЈ¬Ттһй·ЗҪрҢЩФӯЧУ¶јУРөГөҪлҠЧУөДғAПт�Ј¬І»ИЭТЧК§ИҘлҠЧУЈ¬ТІҫНІ»•юРОіЙкҺ�����Ўўк–лxЧУЈ¬ЛьӮғҳӢ(gЁ°u)іЙөД»ҜәПОпТ»°гұ»·Qһй№Іғr»ҜәПОп���Ј¬ИзHCl��ЎўH2O����ЎўCH4�ЎўCO2ЎўHClO(ҙОВИЛб)��ЎўC2H5OH(ТТҙј)�ЎЈТ»°гҒнХfЈ¬Лб�����Ўў·ЗҪрҢЩСх»ҜОп�����ЎўҙуІҝ·ЦУРҷC(jЁ©)ОпөИ¶јҢЩУЪ№Іғr»ҜәПОп�����ЎЈ№Іғr»ҜәПОпҙу¶јКЗУЙ·ЦЧУҳӢ(gЁ°u)іЙөДЈ¬ИзHCl�����ЎўHClO����Ј¬ТІУРҳOЙЩІҝ·ЦКЗУЙФӯЧУҳӢ(gЁ°u)іЙөДЈ¬ИзКҜУўSiO2���ЎўҪр„ӮЙ°SiC�ЎЈ
ЎЎЎЎ[ПлТ»Пл]ЎЎ1.·ЗҪрҢЩФӘЛШРОіЙөД»ҜәПОпТ»¶ЁКЗ№Іғr»ҜәПОпҶб���Јҝ
ЎЎЎЎ[ФҮТ»ФҮ]ЎЎ1.ПВБРОпЩ|(zhЁ¬)ЦР��Ј¬ДДР©КЗлxЧУ»ҜәПОп�Ј¬ДДР©КЗ№Іғr»ҜәПОп�Јҝ
ЎЎЎЎВИ»Ҝҡд(HCl)���ЎўПхЛбвc(NaNO3)�ЎўҡдСх»Ҝвӣ(KOH)����ЎўЖПМСМЗ(C6H12O6)��ЎўБтЛб(H2SO4)���ЎўВИ»Ҝд@(NH4Cl)Ўў¶юСх»ҜМј(CO2)�����ЎўМјЛбв}(CaCO3)�����Ўў°ұҡв(NH3)�����ЎўЙъКҜ»Т(CaO)����ЎЈ
ЎЎЎЎФЪлxЧУ»ҜәПОп№Муw о‘B(tЁӨi)ЦРЈ¬кҺк–лxЧУйgТтмoлҠЧчУГ¶шІ»ДЬЧФУЙТЖ„У��ЎЈҢҰҝЙИЬРФлxЧУ»ҜәПОп¶шСФЈ¬ҢўЖдИЬУЪЛ®ЦР•r����Ј¬№Муw•юИЬҪвПыК§Ј¬ЖдұҫЩ|(zhЁ¬)КЗЛ®·ЦЧУФЪкҺк–лxЧУйgқBНё�����Ј¬І»”аІрЙўкҺк–лxЧУ�����Ј¬К№ЛьӮғРОіЙДЬүтЧФУЙТЖ„УөДлxЧУ�ЎЈЛ®·ЦЧУҢҰлxЧУ»ҜәПОпөДЯ@·NЖЖүДЧчУГЈ¬УИИзөМүОТтәйЛ®ӣ_Лў¶шө№Лъ����Ј¬Л®КЗЦөөГОТӮғГҝӮҖИЛ¶јұШнҡҫҙО·өДТ»·NОпЩ|(zhЁ¬)ЎЈ
ЎЎЎЎ[ПлТ»Пл]ЎЎ2.Кіы}КЗТ»·NөдРНөДлxЧУ»ҜәПОп����Ј¬ФO(shЁЁ)УӢәҶҶОҢҚтһЧCГчФЪКіы}№МуwЦРөДлxЧУІ»ДЬЧФУЙТЖ„УЈ¬¶шФЪКіы}Л®ИЬТәЦРөДлxЧУҝЙТФЧФУЙТЖ„У����ЎЈ(МбКҫЈәҝЙФЪјТЦРЯxУГлҠіШЎўгU№PРҫ�ЎўЩRҝЁЦРөД°l(fЁЎ)№в¶юҳO№ЬәНҢ§(dЁЈo)ҫҖөИФO(shЁЁ)УӢҢҚтһ)
ЎЎЎЎУЙкҺк–лxЧУҳӢ(gЁ°u)іЙөД»ҜәПОпЈ¬іэФЪЛ®ЦРҝЙұ»ІрЙўһйЧФУЙТЖ„УөДлxЧУНв�����Ј¬УГјУҹбИЫИЪөД·ҪКҪ����Ј¬ТІҝЙТФЖЖүДкҺк–лxЧУйgөДмoлҠЧчУГЈ¬К№ЖдіЙһйЧФУЙТЖ„УөДлxЧУ���ЎЈ
ЎЎЎЎФЪ“»р”өДЧчУГПВ��Ј¬№МуwВИ»ҜвcҝЙұ»ҸҠ(qiЁўng)ІрһйЧФУЙТЖ„УөДNaЈ«әНClЈӯ����Ј¬Я@Т»Я^іМКЗ№ӨҳI(yЁЁ)лҠҪвИЫИЪВИ»ҜвcЦЖӮдҪрҢЩвcөДЗ°Мб����Ј»№МуwСх»ҜдX(јУИлұщҫ§КҜЈ¬ҪөөНСх»ҜдXөДИЫьc)ҝЙТФұ»ҸҠ(qiЁўng)ІрһйЧФУЙТЖ„УөДAl3Ј«әНO2Јӯ�����Ј¬Я@Т»Я^іМКЗ№ӨҳI(yЁЁ)лҠҪвИЫИЪСх»ҜдXЦЖӮдҪрҢЩдXөДЗ°МбЎ����Ј»рКЗИЛоҗОДГчЯM(jЁ¬n)ІҪөДПуХчЈ¬ТІКЗТэ°l(fЁЎ)»ҜҢW(xuЁҰ)Чғ»ҜөДТ»·NЦШТӘ·Ҫ·Ё�����ЎЈ
ЎЎЎЎҙуІҝ·Ц№Іғr»ҜәПОпФЪЛ®ЦРәНИЫИЪ о‘B(tЁӨi)¶јІ»ДЬұ»ЦұҪУІр·ЦһйЧФУЙТЖ„УөДлxЧУ��Ј¬Ц»УРҳOЙЩІҝ·ЦөД№Іғr»ҜәПОпИзЛб·ЦЧУ���Ј¬ҝЙТФФЪЛ®ЦРұ»Ір·ЦһйЧФУЙТЖ„УөДкҺк–лxЧУ����Ј¬ИзHCl·ЦЧУҝЙұ»Л®“ІрЙў”һйHЈ«әНClЈӯ���Ј¬H2SO4·ЦЧУҝЙұ»Л®“ІрЙў”һйHЈ«әНSO42Јӯ����ЎЈ
ЎЎЎЎФЪЛ®ЦР»тИЫИЪ о‘B(tЁӨi)ПВ����Ј¬»ҜәПОпұ»ІрЙўіЙЧФУЙТЖ„УлxЧУөДЯ^іМ����Ј¬ұ»·QһйлҠлx�ЎЈлxЧУ»ҜәПОпјИҝЙТФФЪЛ®ЦР°l(fЁЎ)ЙълҠлx�Ј¬ТІҝЙТФФЪИЫИЪ о‘B(tЁӨi)ПВ°l(fЁЎ)ЙълҠлxЈ»№Іғr»ҜәПОпЦРТ»°гЦ»УРЛб·ЦЧУҝЙТФЦұҪУФЪЛ®ЦР°l(fЁЎ)ЙълҠлx����ЎЈТІҫНКЗЛбЦ»ФЪЛ®ЦР°l(fЁЎ)ЙълҠлxЈ¬¶шүAәНы}јИҝЙФЪЛ®ЦР���Ј¬ТІҝЙФЪИЫИЪ о‘B(tЁӨi)ПВ°l(fЁЎ)ЙълҠлx�����ЎЈлҠлxЯ^іМҝЙУГлҠлx·ҪіМКҪұнКҫ��Ј¬І»Ң‘—lјюТ»°гҫНКЗЦёФЪЛ®ЦР°l(fЁЎ)ЙълҠлx���ЎЈ
ЎЎЎЎH2SO4===2HЈ«Ј«SO42Јӯ
ЎЎЎЎNaOH===NaЈ«Ј«OHЈӯ
ЎЎЎЎNaCl===NaЈ«Ј«ClЈӯ
ЎЎЎЎ[ПлТ»Пл]ЎЎ3.ЕР”аПВБР»ҜәПОпКЗ·сҝЙТФ°l(fЁЎ)ЙълҠлxЈ¬Из№ыДЬүтлҠлx�����Ј¬„tУГлҠлx·ҪіМКҪұнКҫлҠлxЯ^іМЎЈ
ЎЎЎЎВИ»Ҝҡд���ЎўҡдСх»Ҝд^����ЎўҡдСх»Ҝвӣ���ЎўБтЛбвc���ЎўМјЛбвcЎў¶юСх»ҜМј�ЎўТ»Сх»ҜМјЎўТТҙј���ЎўЖПМСМЗ����ЎЈ
ЎЎЎЎНЁіЈ���Ј¬ОТӮғ°СДЬ°l(fЁЎ)ЙълҠлxөД»ҜәПОп·QһйлҠҪвЩ|(zhЁ¬)��Ј¬І»ДЬ°l(fЁЎ)ЙълҠлxөД»ҜәПОп·Qһй·ЗлҠҪвЩ|(zhЁ¬)�Ј¬ТІҫНКЗЛбЎўүA�����Ўўы}әНҪрҢЩСх»ҜОпҢЩУЪлҠҪвЩ|(zhЁ¬)�Ј¬¶ш·ЗҪрҢЩСх»ҜОпЎўҙуІҝ·ЦУРҷC(jЁ©)ОпҢЩУЪ·ЗлҠҪвЩ|(zhЁ¬)�����ЎЈ
ЎЎЎЎХбМЗ��ЎўҫЖҫ«���ЎўТ»Сх»ҜМјөИ»ҜәПОпЈ¬ҹoХ“КЗФЪЛ®ИЬТәЦРЯҖКЗФЪИЫИЪ о‘B(tЁӨi)ПВҫщТФ·ЦЧУРОКҪҙжФЪ��Ј¬Тт¶шІ»ДЬҢ§(dЁЈo)лҠ�����Ј»Лб���ЎўүA����Ўўы}әНҪрҢЩСх»ҜОпҝЙТФФЪЛ®ЦР»тИЫИЪ о‘B(tЁӨi)ПВ°l(fЁЎ)ЙълҠлxЈ¬ҝЙТФҢ§(dЁЈo)лҠ�����ЎЈБ•(xЁӘ)‘TЙП�����Ј¬ФЪЛ®ИЬТәЦР»тИЫИЪ о‘B(tЁӨi)ПВДЬҢ§(dЁЈo)лҠөД»ҜәПОпҪРЧцлҠҪвЩ|(zhЁ¬)����Ј¬ФЪЛ®ИЬТәәНИЫИЪ о‘B(tЁӨi)ПВ¶јІ»ДЬҢ§(dЁЈo)лҠөД»ҜәПОпҪРЧц·ЗлҠҪвЩ|(zhЁ¬)ЎЈ
ЎЎЎЎХэҙ_өШ·ЦОцәНЕР”аОпЩ|(zhЁ¬)ФЪЛ®ИЬТәЦРКЗ·слҠлx���ЎўлҠлxЙъіЙДДР©лxЧУ����Ј¬УРЦъУЪСРҫҝОпЩ|(zhЁ¬)ФЪЛ®ИЬТәЦР°l(fЁЎ)ЙъөД»ҜҢW(xuЁҰ)·ҙ‘Ә(yЁ©ng)�ЎЈ
ЎЎЎЎ[ПлТ»Пл]ЎЎ4.ҪрҢЩг~ДЬҢ§(dЁЈo)лҠЈ¬ДЗГҙг~КЗІ»КЗҢЩУЪлҠҪвЩ|(zhЁ¬)�Јҝ
ЎЎЎЎ[ФҮТ»ФҮ]ЎЎ2.ХҲУГёЙлҠіШЎўгU№PРҫЎўТфҳ·ЩRҝЁЦРөД°l(fЁЎ)№в¶юҳO№Ьј°Ң§(dЁЈo)ҫҖөИ�Ј¬ФO(shЁЁ)УӢҢҚтһЧCГчКіы}ЎўҙЧЛбКЗлҠҪвЩ|(zhЁ¬)����Ј¬¶шХбМЗКЗ·ЗлҠҪвЩ|(zhЁ¬)ЎЈ
ЎЎЎЎ[ФҮТ»ФҮ]ЎЎ3.ПВБРОпЩ|(zhЁ¬)ЦР�����Ј¬ДДР©КЗлҠҪвЩ|(zhЁ¬)���Ј¬ДДР©КЗ·ЗлҠҪвЩ|(zhЁ¬)��Јҝ
ЎЎЎЎВИ»Ҝҡд(HCl)ЎўПхЛбд@(NH4NO3)��ЎўҡдСх»Ҝд^[Ba(OH)2]�ЎўЖПМСМЗ(C6H12O6)ЎўБтЛб(H2SO4)���ЎўВИ»Ҝд^(BaCl2)���ЎўМјЛбв}(CaCO3)ЎўГчө\[KAl(SO4)2·12H2O](Т»·NҝЙИЬРФы})ЎўAl2O3��ЎўCO2����ЎЈ
ЎЎЎЎ[ФҮТ»ФҮ]ЎЎ4.өҪДҝЗ°һйЦ№Ј¬ДгДЬҸДДДР©ҪЗ¶ИҢҰ»ҜәПОпЯM(jЁ¬n)РР·Цоҗ�ЎЈ
ЎЎЎЎФЪПаН¬—lјюПВ°СПаН¬қв¶ИЎўПаН¬уw·eөДы}ЛбИЬТә�ЎўCH3COOHИЬТәЎўNaOHИЬТә�����ЎўNaClИЬТәәН°ұЛ®·Ц„eө№ИлОеЦ»ҹэұӯЦР��Ј¬ҪУНЁлҠФҙәуҹфЕЭББ¶ИИзҲDЛщКҫ(¬F(xiЁӨn)ПуЈәҪУы}Лб���ЎўNaOHИЬТә���ЎўNaClИЬТәөДҹфЕЭәЬГчББЈ¬¶шҪУCH3COOHИЬТә��Ўў°ұЛ®өДҹфЕЭПаҢҰЭ^°ө)�����ЎЈОТӮғЦӘөАЈ¬ҹфЕЭББ¶ИІ»Н¬ҙъұнЦшИЬТәЦРҙжФЪөДлxЧУқв¶ИІ»Н¬����Ј¬ҢҰУЪПаН¬ҪMіЙ(ABРН)өДлҠҪвЩ|(zhЁ¬)¶шСФЈ¬ұнГчЛ®ІрҪвЯ@Р©»ҜәПОпіЙһйЧФУЙТЖ„УлxЧУөДДЬБҰІ»Н¬��Ј¬ҹфЕЭББ¶ИФҪҙу����Ј¬ұ»ІрҪвіЙһйЧФУЙТЖ„УлxЧУөДіМ¶ИФҪҙуЈ¬І»Н¬лҠҪвЩ|(zhЁ¬)ФЪЛ®ЦРөДлҠлxіМ¶ИҫНІ»Н¬�ЎЈёщ“ю(jЁҙ)ҫ«ҙ_ҢҚтһұнГчHClЎўNaOH��ЎўNaClөИ»ҜәПОпФЪЛ®ЦРҺЧәхИ«ІҝҝЙТФ°l(fЁЎ)ЙълҠлx�Ј¬¶шCH3COOH����Ўў°ұЛ®(NH3·H2O)ФЪЛ®ЦРЦ»ДЬІҝ·Ц°l(fЁЎ)ЙълҠлxЈ¬ҙуІҝ·ЦИФТФ·ЦЧУөДРОКҪҙжФЪ���Ј¬ҙжФЪлxЧУ”ө(shЁҙ)БҝәЬЙЩ�Ј¬қв¶ИәЬөНЎЈНЁіЈОТӮғ°СФЪЛ®ЦРНкИ«лҠлxіЙлxЧУөДлҠҪвЩ|(zhЁ¬)·QһйҸҠ(qiЁўng)лҠҪвЩ|(zhЁ¬)�Ј¬лҠлx·ҪіМКҪУГ“===”ұнКҫЈ»¶шФЪЛ®ЦРІҝ·Ц°l(fЁЎ)ЙълҠлxөДлҠҪвЩ|(zhЁ¬)·QһйИхлҠҪвЩ|(zhЁ¬)�Ј¬лҠлx·ҪіМКҪУГ“??”ұнКҫЎЈ

|
|
ҸҠ(qiЁўng)лҠҪвЩ|(zhЁ¬)
|
ИхлҠҪвЩ|(zhЁ¬)
|
|
ПаН¬ьc
|
¶јКЗ»ҜәПОп����Ј¬ФЪЛ®ИЬТәЦР¶јДЬлҠлxЎўҢ§(dЁЈo)лҠ
|
|
лҠлx
|
|
|
|
іМ¶И
|
НкИ«
|
ҳOРЎІҝ·ЦлҠлx
|
|
ИЬЩ|(zhЁ¬)
|
|
|
|
РОКҪ
|
лxЧУ
|
ЦчТӘКЗ·ЦЧУ�Ј¬РЎІҝ·ЦһйлxЧУ
|
|
ОпЩ|(zhЁ¬)оҗ„e
|
ҸҠ(qiЁўng)ЛбЎўҸҠ(qiЁўng)үA����Ўўҙу¶а”ө(shЁҙ)ы}оҗ
|
ИхЛбЎўИхүA����ЎўЛ®өИ
|
|
ҢҚАэ
|
HClЎўNaOH ���ЎўKCl��ЎўNaHSO4����ЎўNaHCO3ЎўBaSO4
|
CH3COOH����ЎўH2CO3ЎўNH3·H2O�ЎўH2O
|
|
лҠлxұнКҫ
|
NaCl===NaЈ«Ј«ClЈӯ
|
CH3COOH??CH3COOЈӯЈ«HЈ«
|
ЎЎЎЎ[ФҮТ»ФҮ]ЎЎ5.ФЪПВБРОпЩ|(zhЁ¬)ЦРЈ¬ДДР©КЗлҠҪвЩ|(zhЁ¬)���Ј¬ДДР©КЗ·ЗлҠҪвЩ|(zhЁ¬)����Ј¬ДДР©КЗҸҠ(qiЁўng)лҠҪвЩ|(zhЁ¬)����Ј¬ДДР©КЗИхлҠҪвЩ|(zhЁ¬)Ј¬Ң‘іцҢҰ‘Ә(yЁ©ng)өДлҠлx·ҪіМКҪ��Јҝ
ЎЎЎ����ЎўЩNaNO3Ў�����ЎўЪFeЎЎўЫH2SO4Ў�ЎўЬCO2ЎЎўЭBa(OH)2
ЎЎЎ�����ЎўЮCH3COOHЎ��ЎўЯNH3Ў�ЎўаNH3·H2OЎЎўбAgClЎ���ЎўвH2CO3
РВіхИэҝм’ЯҙaкP(guЁЎn)Чў
ЦРҝјҫW(wЁЈng)ОўРЕ№«ұҠМ–
ГҝИХНЖЛНҢW(xuЁҰ)Б•(xЁӘ)јјЗЙ��Ј¬ҢW(xuЁҰ)ҝЖЦӘЧRьc
ЦъДгУӯҪУ2020ДкЦРҝј���ЈЎ
ЎЎЎЎ ҡgУӯК№УГКЦҷC(jЁ©)ЎўЖҪ°еөИТЖ„УФO(shЁЁ)ӮдФLҶ–ЦРҝјҫW(wЁЈng)��Ј¬2023ЦРҝјТ»В·Ег°йН¬РР���ЈЎ>>ьc“фІйҝҙ