1F
ŋžücŌŧĢš―ðŲēÄÁÏ
(Ōŧ)���ĄĒž―ðŲēÄÁÏĢšž―ðŲ(90ķā·N)

(ķþ)ĄĒšÏ―ð(ŨĮ§·N)ĢšÓÉŌŧ·N―ðŲļúÆäËûŌŧ·NŧōŨ·N―ðŲ(ŧō―ðŲÅc·Į―ðŲ)ŌŧÆðČÛšÏķøģÉĩÄūßÓÐ―ðŲĖØÐÔĩÄÎïŲ|(zhĻŽ)��ĄĢ
1. ―ðŲēÄÁÏ°üĀĻž―ðŲšÍšÏ―ðÉî�ĄĢ―ðŲŲÓÚ―ðŲēÄÁÏĢŽĩŦ―ðŲēÄÁÏēŧŌŧķĻĘĮž―ðŲ���ĢŽŌēŋÉÄÜĘĮšÏ―ðĄĢ
2. šÏ―ðŋÉÄÜĘĮ―ðŲÅc―ðŲ―MģÉ�ĢŽŌēŋÉÄÜĘĮ―ðŲÅc·Į―ðŲ―MģÉĄĢ―ðŲēÄÁÏÖÐĘđÓÃąČÝ^V·šĩÄĘĮšÏ―ð��ĄĢ
šÏ―ðĩÄ(yĻu)ücĢš
(1)ČÛücļß���ĄĒÃÜķČÐĄ;(2)ŋÉËÜÐÔšÃ����ĄĒŌŨÓÚžÓđĪ�����ĄĒCÐĩÐÔÄÜšÃ;(3)ŋđļŊÎgÐÔÄÜšÃ;
ÏÂÃæĘĮüSã~šÍã~ÆŽĢŽšļåašÍåa�����ĢŽäXšÏ―ðšÍäXūĩÄÓÐęP(guĻĄn)ÐÔŲ|(zhĻŽ)ąČÝ^Ģš
âšÏ―ðĩÄ(yĻu)ücĢšĒŲ ČÛücļß�����ĄĒÃÜķČÐ�����Ą���ĢŧĒÚ ŋÉËÜÐÔšÃ�����ĄĒŌŨÓÚžÓđĪ���ĄĒCÐĩÐÔÄÜšÃĢŧĒÛ ŋđļŊÎgÐÔÄÜšÃ
âšÍâšÏ―ðĢšąŧÕJéĘĮ21ĘĀžoĩÄÖØŌŠ―ðŲēÄÁÏ�ĢŽâšÏ―ðÅcČËówÓКܚÃĩÄ“ÏāČÝÐÔ”��ĢŽŌōīËŋÉÓÃíÖÆÔėČËÔėđĮĩČ�����ĄĢ
âæšÏ―ðūßÓГӔÄÜÁĶ�ĢŽŋÉÓŨĄÄģĖØķĻØķČÏÂĩÄÐÎ î�ĢŽÖŧŌŠÍ(fĻī)ŧØß@ØķČĢŽūÍþŧÖÍ(fĻī)ĩ―ß@ØķČÏÂĩÄÐÎ î��ĢŽÓÖąŧ·Qé“Ó―ðŲ”�����ĄĢīËÍâ���ĢŽâßŋÉÖÆČĄģŽ§(dĻĢo)ēÄÁÏĢŽÃĀøÉúŪa(chĻĢn)ĩÄģŽ§(dĻĢo)ēÄÁÏÖÐĩÄ90%ĘĮÓÃââšÏ―ðÖÆÔėĩÄ�����ĄĢ
3. ŨĒŌâĢš(1)šÏ―ðĘĮ―ðŲÅc―ðŲŧō―ðŲÅc·Į―ðŲĩÄŧėšÏÎï���ĄĢ(2)šÏ―ðĩÄšÜķāÐÔÄÜÅc―MģÉËüĩÄž―ðŲēŧÍŽ���ĢŽĘđšÏ―ðļüČÝŌŨßmÓÚēŧÍŽĩÄÓÃÍū���ĄĢ(3)ČÕģĢĘđÓÃĩÄ―ðŲēÄÁÏĢŽīóķāĩ(shĻī)éšÏ―ð����ĄĢ(4)―ðŲÔÚČÛšÏÁËÆäËü―ðŲšÍ·Į―ðŲšóĢŽēŧH―MģÉÉÏ°l(fĻĄ)ÉúÁËŨŧŊ�ĢŽÆäČ(nĻĻi)ēŋ―MģÉ―Y(jiĻĶ)(gĻ°u)Ōē°l(fĻĄ)ÉúÁËļÄŨĢŽÄķøŌýÆðÐÔŲ|(zhĻŽ)ĩÄŨŧŊ�ĄĢ
4. 2.šÏ―ðĩÄÐÎģÉlžþĢšÆäÖÐČÎŌŧ―ðŲĩÄČÛücēŧÄÜļßÓÚÁíŌŧ―ðŲĩÄ·Ðüc(ŪÉ·N―ðŲÐÎģÉšÏ―ðr)ĄĢ
5. Įāã~ĘĮČËîvĘ·ÉÏĘđÓÃŨîÔįĩÄšÏ―ð;ÉúčFšÍäĘĮČËîĀûÓÃŨîV·šĩÄšÏ―ð.
6. šÏ―ðķžŲÓÚŧėšÏÎï���ĄĢ
2F
ŋžüc2Ģš―ðŲĩÄÎïĀíÐÔŲ|(zhĻŽ)
(1)ģĢØÏÂŌŧ°ãéđĖB(tĻĪi)(đŊéŌšB(tĻĪi))���ĢŽÓÐ―ðŲđâÉĄĢ(2)īóķāĩ(shĻī)ģĘãy°ŨÉŦ(ã~éŨÏžtÉŦ����ĢŽ―ðéüSÉŦ)(3)ÓÐÁžšÃĩħ(dĻĢo)áÐÔĄĒ§(dĻĢo)ëÐÔ��ĄĒŅÓÕđÐÔ(4)ÃÜķČšÍÓēķČÝ^īóĢŽČÛ·ÐücÝ^ļß���ĄĢ ŨĒĢš―ðŲĩÄÎïĀíÐÔŲ|(zhĻŽ)ĘĮÖŧËųÓÐ―ðŲķžÓÐĩÄđēÍŽÐÔŲ|(zhĻŽ)����ĢŽķøēŧĘĮÖļÄģŌŧ―ðŲĩÄĖØÓÐÐÔŲ|(zhĻŽ)���ĄĢ
3F
ŋžüc3 Ģš―ðŲÖŪŨî
(1)äXĢšĩØĪÖКŽÁŋŨîķāĩÄ―ðŲÔŠËØ (2)â}ĢšČËówÖКŽÁŋŨîķāĩÄ―ðŲÔŠËØ(3)čFĢšÄŋĮ°ĘĀ―įÄęŪa(chĻĢn)ÁŋŨîķāĩÄ―ðŲ(čF>äX>ã~)(4)ãyĢš§(dĻĢo)ë�����ĄĒ§(dĻĢo)áÐÔŨîšÃĩÄ―ðŲ(ãy>ã~>―ð>äX)(5)ãtĢšÓēķČŨîļßĩÄ―ðŲ (6)æuĢšČÛücŨîļßĩÄ―ðŲ(7)đŊĢšČÛücŨîĩÍĩÄ―ðŲ (8)ä~ĢšÃÜķČŨîīóĩÄ―ðŲ(9)ä ĢšÃÜķČŨîÐĄĩÄ―ðŲ
4F
ŋžüc4Ģš―ðŲÅcŅõâĩÄ·īŠ(yĻĐng)
5F
ŋžüc5Ģš―ðŲÅcËáĩÄ·īŠ(yĻĐng)
6F
ŋžüc6ĢšŲÅcŧŊšÏÎïČÜŌšĩÄ·īŠ(yĻĐng)
7F
ŋžüc 7 ĢšÖÃQ·īŠ(yĻĐng)
ÖÃQ·īŠ(yĻĐng)ĢšÓÉŌŧ·NÎŲ|(zhĻŽ)ÅcŌŧ·NŧŊšÏÎï·īŠ(yĻĐng)�����ĢŽÉúģÉÁíŌŧ·NÎŲ|(zhĻŽ)ÅcŧŊšÏÎïĩÄ·īŠ(yĻĐng)―ÐŨöÖÃQ·īŠ(yĻĐng)��ĄĢ
8F
ŋžüc8 Ģš―ðŲŧîÓÐÔíÐō
1�ĄĒģĢŌ―ðŲĩÄŧîÓÐÔíÐōĢš
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
2��ĄĒŌâÁxĢšĒŲHīúąíËáÖÐĩÄäÔŠËØ;ĒÚ―ðŲĩÄÎŧÖÃÔ―ŋŋĮ°�ĢŽËüĩÄŧîÓ

ÐÔūÍÔ―;ĒÛÔÚ―ðŲŧîÓÐÔíÐōĀï�ĢŽÎŧÓÚäĮ°ÃæĩÄ―ðŲÄÜÖÃQģöû}ËáĄĒÏĄÁōËáÖÐĩÄä(ēŧŋÉÓÃâÁōËáĄĒÏõËá);ĒÜÎŧÓÚĮ°ÃæĩÄ―ðŲÄÜ°ŅÎŧÓÚšóÃæĩÄ―ðŲÄËüĩÄû}ČÜŌšÖÐÖÃQģöí���ĄĢ(ģýK���ĄĒCaĄĒNa)
3����ĄĒŠ(yĻĐng)ÓÃĢšĒŲÓÃÓÚÅÐā―ðŲĘĮ·ņÅcËá°l(fĻĄ)ÉúÖÃQ·īŠ(yĻĐng);ĒÚÓÃÓÚÅÐā―ðŲÅcËá°l(fĻĄ)ÉúŧŊW·īŠ(yĻĐng)ĩÄĄÁŌģĖķČ;ĒÛÓÃÓÚÅÐā―ðŲÅcû}ÄÜ·ņ°l(fĻĄ)ÉúÖÃQ·īŠ(yĻĐng)ĄĢ
ŨĒŌâĢš
1����ĄĒ―ðŲÅcû}ĩÄ·īŠ(yĻĐng)ąØíÔÚ“û}ČÜŌš”ÖÐßMÐÐĢŽ·ņtēŧÄÜ·īŠ(yĻĐng)�ĢŽČįĢšCuŋÉŌÔÅcAgNO3ČÜŌš·īŠ(yĻĐng)ÖÃQģöAgĢŽĩŦēŧÄÜÅcAgCl·īŠ(yĻĐng)����ĄĢ
2ĄĒŌēŋÉļųþ(jĻī)·īŠ(yĻĐng)ĘĮ·ņ°l(fĻĄ)Éúž°·īŠ(yĻĐng)ĄÁŌģĖķČíÅÐā―ðŲĩÄŧîÓÐÔČõ�ĄĢ
3ĄĒK�ĄĒCaĄĒNaČý·N―ðŲĩÄŧîÓÐÔĖŦ���ĢŽģýÅcËá·īŠ(yĻĐng)Íâ�ĢŽßÄÜÅcËŪÔÚģĢØÏ°l(fĻĄ)ÉúÖÃQ·īŠ(yĻĐng)(Čį2Na+2H2O=2NaOH+H2↑)ĢŽÆäÓā―ðŲtēŧÄÜ
9F
ŋžüc9ĢšĩVĘŊ
1. ―ðŲŲYÔīĩÄīæÔÚ·―Ę―ĢšĩØĮōÉÏĩÄ―ðŲŲYÔīV·šīæÔÚÓÚĩØĪšÍšĢŅóÖÐ�ĢŽīóķāĩ(shĻī)―ðŲŧŊšÏÎïÐÔŲ|(zhĻŽ)Ý^ŧîĢŽËųŌÔËüŌÔŧŊšÏÎïĩÄÐÎĘ―īæÔÚ;ÖŧÓÐÉŲĩ(shĻī)―ðŲŧŊWÐÔŲ|(zhĻŽ)šÜēŧŧî����ĢŽČį―ðĄĒãyĩČŌÔÎŲ|(zhĻŽ)ÐÎĘ―īæÔÚ���ĄĢ
2. ĩVĘŊĢšđĪI(yĻĻ)ÉÏ°ŅÄÜĖá―ðŲĩÄĩVÎï―ÐĩVĘŊ����ĄĢ
3. ģĢŌĩVĘŊÃû·QÅcÆäÖũŌŠģÉ·ÖĢš
10F
ŋžüc10ĢšŌŧŅõŧŊĖžßÔŅõŧŊčF
1�����ĄĒčFĩÄŧųąūÔĀíĘĮĢšÔÚļßØlžþÏÂ�����ĢŽĀûÓÃ―đĖŋÅcŅõâ·īŠ(yĻĐng)ÉúģÉĩÄŌŧŅõŧŊĖž°ŅčFÄčFĩVĘŊĀïßÔģöí�����ĄĢ3CO + Fe2O3
ļßØ
2Fe + 3CO2
2�ĄĒčFĩÄÔÁÏĢščFĩVĘŊ[ģĢŌĩÄčFĩVĘŊÓÐīÅčFĩV(ÖũŌŠģÉ·ÖĘĮFe3O4)šÍģāčFĩV(ÖũŌŠģÉ·ÖĘĮFe2O3)]ĄĒ―đĖŋ����ĄĒĘŊŧŌĘŊšÍŋÕâĢŽÖũŌŠÔO(shĻĻ)äĘĮļß t��ĄĢ(1)xÆũĢščFžÜÅ_(2)���ĄĒÓēŲ|(zhĻŽ)ēĢÁ§đÜ�����ĄĒÎŋŨÏðÆĪŲ(2)���ĄĒūÆūŦôĄĒÔđÜ�ĄĒūÆūŦôĄĒëpŋŨÏðÆĪŲ���ĄĒ§(dĻĢo)âđÜ�ĄĢ(2)ËÆ·ĢšŅõŧŊčF·ÛÄĐ���ĄĒģÎĮåĘŊŧŌËŪ��ĄĒŌŧŅõŧŊĖžâ(3)ŅbÖÃDĢš
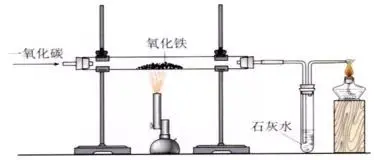
(4)ē―óEĢšĒŲzōŅbÖÃĩÄâÃÜÐÔ;ĒÚŅbČëËÆ·ēĒđĖķĻ;ĒÛÏōēĢÁ§đÜČ(nĻĻi)ÍĻČëŌŧŅõŧŊĖžâów;ĒÜ―oŅõŧŊčFžÓá;ĒÝÍĢÖđžÓá;ĒÞÍĢÖđÍĻČëŌŧŅõŧŊĖž�ĄĢ(5)ŽF(xiĻĪn)ÏóĢšžtÉŦ·ÛÄĐÖðuŨģÉšÚÉŦĢŽģÎĮåĘŊŧŌËŪŨá���ĢŽÎēâČžýŪa(chĻĢn)ÉúË{ÉŦŧðŅæ��ĄĢ(6)ŧŊW·―ģĖĘ―Ģš

Ca(OH)2+CO2=CaCO3↓+H2O
(7)ŨĒŌâĘÂíĢšÅcCOßÔŅõŧŊã~ĩÄōēŲŨũíÐōŌŧÓ��ĢŽžīÏČÍĻČëCOÔŲžÓá��ĢŽōÍęŪ
����ĢŽÍĢÖđžÓá��ĢŽĀ^Ām(xĻī)ÍĻČëCOÖÁÔđÜĀä
s��ĄĢĒÚ�ĄĒōÖũŌŠŽF(xiĻĪn)ÏóĢšžtÉŦ·ÛÄĐŨ?yĻu)éšÚÉŦrĢŽģÎĮåĩÄĘŊŧŌËŪŨ

á��ĢŽÎēâücČžŪa(chĻĢn)ÉúĩË{ÉŦŧðŅæ��ĄĢĒÛōŨĒŌâĘÂíĢšÏČÄÜšóücĢŽÏČģ·šóÍĢ

��ĄĢ
(8)ÎēâĖĀíĢšŌōCOÓÐķū�ĢŽēŧÄÜëSŌâÅÅ·ÅÔÚŋÕâÖÐ����ĢŽĖĀíĩÄÔtĘĮĒCOČžýĩôÞD(zhuĻĢn)ŧŊéoķūĩÄCO2ŧōĘÕžŊäÓÃĄĢ
ĄĄĄĄ gÓĘđÓÃĘÖC�����ĄĒÆ―°åĩČŌÆÓÔO(shĻĻ)äÔLÖÐŋžūW(wĻĢng)���ĢŽ2023ÖÐŋžŌŧ·Åã°éÍŽÐÐ���ĢĄ>>ücôēéŋī











